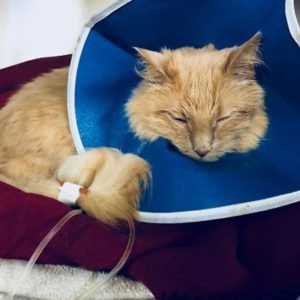
对于许多宠物来说,去看兽医可能是一次充满压力的经历,对于某些宠物,比如甜美但焦虑的猫咪Hetch-Hetchy来说,这甚至可能导致严重的健康问题。Hetch的主人是一位兽医,她分享了Hetch的故事,旨在强调兽医医学中一种令人担忧的做法:使用吸入麻醉箱“击倒”动物进行麻醉。本文深入探讨了为什么这种方法是有害的,以及为什么优先考虑无恐惧的方法对于我们心爱的伴侣至关重要,也是朝着真正让宠物摆脱兽医焦虑迈进的关键一步。
Hetch-Hetchy因兽医就诊而引发尿道阻塞 (UO) 的病史,突显了压力对猫咪健康可能产生的深远影响。尽管他的主人采取了积极的措施,包括预先用药并选择了一家值得信赖的专科医院,Hetch仍然经历了一次创伤性的“击倒”事件。他没有接受快速的注射麻醉,而是被关在一个充满气体麻醉剂的箱子里。结果是一只惊慌失措的猫,以及随之而来的数天躲藏和拒绝进食,这清楚地表明了心理创伤的影响。不幸的是,这种经历并非个例,因为在某些兽医机构中,吸入麻醉箱的使用仍然是一种惯例。这提出了一个关键问题:当存在更好的替代方案来确保宠物无恐惧时,我们为什么还在使用这种已被证明会带来压力且可能危险的方法?
“击倒”宠物的危害
使用吸入麻醉箱或面罩来镇静或诱导麻醉的做法,通常被称为“击倒”或“面罩麻醉”,正日益被认为是低于标准的护理。虽然对于不配合的动物来说,这似乎是一种快速的解决方案,但对宠物和人类的风险,加上它引起的巨大压力,远远超过了任何所谓的便利性。为了让宠物真正摆脱恐惧,我们必须摒弃像吸入麻醉箱这样过时且有害的做法。
-
宠物的健康风险:
研究表明,吸入诱导麻醉显著增加了麻醉死亡的风险。Brodbelt(2009)的研究强调,仅使用吸入麻醉剂诱导和维持麻醉会增加麻醉风险,因为诱导需要高浓度麻醉剂。
这些高浓度麻醉剂可能导致血压危险下降(低血压)和呼吸抑制。此外,面罩或麻醉箱诱导会延长没有受保护气道(气管插管)的时间,增加气道阻塞的风险。这使得吸入诱导麻醉对所有动物都特别危险,并且特别禁用于短头颅品种,这些品种以呼吸敏感性而闻名。
麻醉的兴奋期(第二期),其特征是谵妄和不受控制的运动,在吸入诱导麻醉中会被放大和延长。这需要更高剂量的麻醉剂,并会引发应激激素(儿茶酚胺)的释放。这种激增会导致心率加快(心动过速)、血压升高(高血压)和呼吸急促(过度通气),可能导致心律失常甚至心脏骤停。即使在维持麻醉期间,与使用术前用药或注射诱导药物的方案相比,也需要更高浓度的吸入麻醉剂。
-
兽医人员和主人的风险:
吸入麻醉剂不仅对宠物构成风险,也对兽医保健团队和在场宠物主人构成风险。诱导麻醉箱和面罩永远不可能完全防漏,导致麻醉气体泄漏到环境中。接触这些废弃麻醉气体与各种健康问题有关,从自发性流产等生殖问题(Shirangi等人,2008年)到遗传损伤(Cakmak等人,2019年)。OSHA警告说,潜在的影响包括恶心、头晕、头痛、疲劳,以及更严重的长期风险,如不育、流产、出生缺陷、癌症以及肝脏和肾脏疾病。优先考虑无恐惧措施也意味着确保兽医专业人员更安全的工作环境。
-
压力和焦虑增加:
压力被定义为对动物稳定内部环境(体内平衡)的威胁,吸入麻醉箱会显著放大压力。这些麻醉箱创造了一种不可控和无法逃避的压力源,引发强烈的应激反应。为了让宠物真正摆脱恐惧,我们需要最大限度地减少这些压力源。
身体对急性压力的即时“战斗或逃跑”反应(SAM轴激活)会导致身体变化,如瞳孔放大、心率加快和血压升高。较慢、较长期的应激反应(HPA轴激活)涉及糖皮质激素的释放,影响新陈代谢、免疫功能、消化、生长和繁殖(Hekman,2014年)。总体效果是以牺牲基本身体功能为代价来调动能量。
研究证实,吸入麻醉箱是重要的压力源。对小鼠(Reiter等人,2017年)和兔子(Flecknell等人,1996年,1999年)的研究表明,应激激素水平升高、行为躁动、屏气以及试图避开麻醉蒸气,都表明这是一种高度厌恶的体验。与注射麻醉剂相比,吸入麻醉剂相关的诱导时间较慢,进一步加剧了挣扎和痛苦(Lester等人,2012年)。
-
对发病率和死亡率的影响:
压力对健康有明确的负面影响,这在不同物种中都有文献记载。它会削弱免疫系统,增加感染和败血症的易感性,延缓伤口愈合,并增加胃溃疡的风险(Hekman,2014年)。在猫咪中,压力与猫特发性膀胱炎 (FIC) 中膀胱通透性增加有关(Westropp,2006年)。急性压力也可能导致高血糖症,甚至在某些猫咪中模拟糖尿病水平(Rand等人,2002年),可能导致误诊和不必要的治疗。在诱导麻醉箱中的身体挣扎甚至可能导致直接损伤。
-
使恐惧和焦虑长期存在:
接受吸入麻醉箱治疗的动物通常是那些已经表现出恐惧和攻击性的动物,这使得保定具有挑战性。然而,使用像“击倒”这样充满压力的方法只会加强和加剧它们的恐惧。研究表明,即使是健康的犬猫,也有很大一部分在兽医诊所表现出恐惧(Döring等人,2009年;Quimby等人,2011年;Mariti,2016年)。
一次创伤性经历可能会产生长期后果(Koolhaas,1997年;Landsberg,2013年)。Mariti(2016年)发现,对于34%的猫咪来说,兽医就诊压力会加剧在其他情况下被触碰时的不良反应。吸入麻醉箱很可能会在宠物心中对兽医就诊产生负面联想,使未来的护理更具挑战性,并阻碍实现让宠物在兽医处摆脱恐惧的目标。
-
损害患者护理和员工安全:
因吸入麻醉箱诱导等压力程序而增加的恐惧和攻击性可能会使后续治疗和药物给药变得更加困难和危险,无论是在诊所还是在家中。犬猫咬伤和抓伤是兽医人员受伤的主要原因(Jeyaretnam,2000年)。减少宠物的恐惧对于员工安全和更积极的工作环境至关重要。
-
兽医诊所的经济影响:
宠物压力是宠物主人寻求兽医护理的主要障碍(Volk,2011年)。许多猫主人表示,他们的猫讨厌去看兽医,而且仅仅是想到这件事自己也会感到压力(Volk,2011年)。负面经历可能导致主人避免未来的就诊或更换兽医(Rodan,2005年)。与犬类相比,猫咪接受定期兽医护理的可能性已经较低(Volk,2011年)。充满压力的就诊进一步加剧了这种差距,阻碍兽医诊所接触猫咪市场并提供最佳护理。创建无恐惧诊疗不仅在道德上是合理的,而且在经济上也是有益的。
化学保定:一种更温和的方法,而非最后的手段
化学保定,即使用药物来镇静和安抚动物,通常是必要的,不应被视为最后的手段,而应视为确保宠物无恐惧的主要工具。美国猫科动物医师协会/国际猫科动物医学协会的指南提倡在涉及恐惧、焦虑、压力、攻击性、预期疼痛或温柔保定不足以确保安全的情况下使用化学保定。
幸运的是,存在许多吸入诱导麻醉的替代方案,首先是从家中服用的就诊前药物 (PVP) 开始。
就诊前药物 (PVP):为平静奠定基础
PVP可以显著减少对吸入麻醉箱等压力程序甚至注射镇静剂或全身麻醉的需求。它们使保定更容易,对每个人都更愉快。“恐惧、焦虑和压力 (FAS) 量表”有助于评估宠物的焦虑水平,并确定是否需要PVP。
在FAS量表上得分2或3分(对零食略微不感兴趣,烦躁不安)的宠物表现出中度焦虑,并可从PVP中获益。得分4或5分(对零食不感兴趣,战斗/逃跑/僵住反应,攻击性)表明高度焦虑,需要PVP,并可能需要注射镇静剂。兽医团队应在预约安排期间主动讨论宠物的恐惧和焦虑史,并推荐适当的PVP,如加巴喷丁、曲唑酮、丁丙诺啡、经粘膜右美托咪定或苯二氮卓类药物。
有效PVP的例子
在兽医就诊前在家中测试PVP至关重要,以了解其对个体宠物的影响。需要评估起效时间、持续时间和潜在副作用等因素,以优化PVP计划。
- 加巴喷丁: 虽然加巴喷丁并非专门标记用于治疗焦虑,但它越来越多地用于其在宠物和人类身上的镇静作用。研究表明,它可以减轻猫咪在运输和兽医检查期间的压力(van Haaften等人,2017年)。剂量因猫咪大小而异。副作用可能包括镇静、共济失调和食欲增加。在就诊前3小时服用,可能在前一天晚上服用一次剂量。
- 曲唑酮: 这种血清素拮抗剂再摄取抑制剂是一种有效的抗焦虑药和猫咪镇静剂。在就诊前3小时,每只猫服用50-100毫克。副作用可能包括嗜睡、胃肠道不适或反常性兴奋。在家中进行剂量测试对于确定正确剂量至关重要。
- 苯二氮卓类药物(劳拉西泮、阿普唑仑): 这些强效抗焦虑药起效迅速,适用于严重焦虑,但不建议用于具有攻击性的宠物,因为可能出现反常性兴奋。在家中进行测试以评估不良反应,如共济失调、镇静或食欲增加。劳拉西泮和阿普唑仑常用于猫咪,劳拉西泮是老年或肝功能受损患者的首选。在就诊前2-3小时服用。
- 丁丙诺啡: 丁丙诺啡是一种部分μ-阿片激动剂,可提供镇痛和轻度镇静作用,在平衡镇静方案中非常有用。在就诊前2-3小时,经粘膜给药,剂量为0.01-0.02毫克/千克。副作用包括镇静和潜在的体温变化。
- Sileo(经粘膜右美托咪定): Sileo已获得FDA批准用于治疗犬类噪音厌恶症,也常被超说明书用于治疗猫咪和犬类的焦虑症。它起效迅速,镇静作用极小,并且可以与丁丙诺啡联合使用以增强效果。在就诊前60分钟给药。
PVP不仅可以减轻宠物的焦虑,还可以促进在需要时更安全、更容易地施用注射麻醉前药和麻醉剂。
运输和到达:保持平静
建议宠物主人将宠物放在柔软、易于取出的宠物箱中运输。到达后,立即将宠物箱放在安静的房间里,用喷洒了Feliway的毛巾盖住猫咪的宠物箱,以进一步减轻压力。
温柔的操作和无恐惧技巧对于最大限度地减少压力和最大限度地提高镇静或麻醉期间的安全性至关重要(Yin,2009年;Rodan等人,2011年)。适当的操作甚至可以减少对全身麻醉的需求。
从宠物箱中取出和温柔保定
避免强行将宠物从宠物箱中拉出或摇晃出来。对于放在软宠物箱中的胆小宠物,可以通过宠物箱直接进行肌肉注射。对于带有可拆卸顶部的硬宠物箱,在用毛巾覆盖宠物的同时逐渐取下顶部,提供安全和温柔的保定,以便进行检查和注射。
注射镇静剂方案
如果需要更深度的镇静,则优选使用注射药物的平衡镇静方案,而不是吸入麻醉箱。方案包括阿片类药物、右美托咪定/美托咪定、咪达唑仑、阿法沙龙、Telazol和氯胺酮。如果可以进行静脉通路,则可以添加丙泊酚。请注意,预先存在的恐惧和压力可能会影响注射镇静剂的疗效,可能需要调整剂量。始终为深度镇静或麻醉的患者提供补充氧气和监测。
- 阿片类药物(美沙酮、吗啡、氢吗啡酮、丁丙诺啡、布托啡诺): μ-激动剂如美沙酮、吗啡和氢吗啡酮为疼痛性手术提供强效镇痛作用。丁丙诺啡提供中度镇痛和镇静作用。布托啡诺是一种温和、短效的镇静剂,通常与α-2激动剂联合使用。建议用止吐药如马罗匹坦进行预处理,因为可能出现恶心。
- α-2激动剂(右美托咪定、美托咪定): 这些药物提供快速镇静和镇痛作用,且效果可逆。它们减少了对诱导和维持麻醉剂的需求,但可能导致最初的高血压,随后是心动过缓和潜在的恶心。在患有心血管疾病的患者中谨慎使用。
- 阿法沙龙: 阿法沙龙是一种注射麻醉剂,起效快,持续时间短,适用于镇静或麻醉。它副作用极小,可以与其他麻醉前药联合使用。肌肉注射对于猫咪来说是实用的,但对于较大的动物来说则不然。
- 氯胺酮: 氯胺酮是一种分离麻醉剂,肌肉注射有效,低剂量时可提供镇痛作用。通常与苯二氮卓类药物联合用于诱导麻醉。在患有癫痫、颅内疾病、肥厚型心肌病或猫肾脏疾病的患者中谨慎使用。
- Telazol(替来他明/唑拉西泮): Telazol是分离麻醉剂和苯二氮卓类药物的组合,由于其肌肉注射体积小且起效迅速,因此非常适合高度恐惧的动物。在患有胰腺、呼吸系统或心血管疾病的患者中谨慎使用,并遵循与氯胺酮类似的预防措施。
结论:优先考虑无恐惧措施,让宠物更健康、更快乐
吸入麻醉箱和面罩对于宠物和兽医人员来说都是过时、危险且充满压力的。压力对健康和福祉产生负面影响。由于有许多更安全、更人道的替代方案,应从兽医实践中消除吸入麻醉箱。优先考虑无恐惧方法,包括就诊前药物、温柔操作和平衡镇静方案,对于创造积极的兽医体验、改善患者健康以及培养更牢固的宠物-主人-兽医关系至关重要。通过拥抱无恐惧方法,我们可以朝着一个兽医就诊不再是我们心爱的动物伴侣的恐惧之源的未来迈进,确保宠物在各个方面都真正无恐惧。
表格:麻醉阶段和平面
| 阶段 | 描述 | 详情 |
|---|---|---|
| 1 | 定向障碍、镇静 | 发生在麻醉前用药后 |
| 2 | 谵妄、兴奋、不受控制的运动 | 发生在诱导和恢复期间。麻醉计划应设计为使患者在此阶段花费的时间最少。诱导应快速(使用注射药物),如果出现兴奋/烦躁不安,恢复应包括镇静剂。 |
| 3 | 意识丧失,手术麻醉平面 | 平面1:浅麻醉,深度不足以进行中度至重度疼痛手术,除非局部麻醉阻滞是方案的一部分。平面2:中度麻醉,足以进行疼痛手术并施用适当的镇痛药。平面3:深度麻醉,如果镇痛药不是方案的一部分,则需要深度麻醉。在此平面中发生的生理抑制比以前的平面更严重。平面4:过深的麻醉,危险的生理抑制。关闭汽化器并开始为患者通气,以加速吸入麻醉剂的消除。 |
| 4 | 太深了! | 此阶段介于呼吸骤停和循环衰竭之间。停止麻醉并准备进行心肺复苏。 |



参考文献
Brodbelt D. Perioperative mortality in small animal anaesthesia. The Veterinary Journal. 2009; 182:152–161.
Çakmak G, Eraydın D, Berkkan A, Yağar S, Burgaz S. Genetic damage of operating and recovery room personnel occupationally exposed to waste anaesthetic gases. Hum Exp Toxicol. 2019 Jan;38(1):3-10.
Costa RS, Karas AZ, Borns-Weil S. Chill Protocol to Manage Aggressive & Fearful Dogs. Clinicians Brief May 2019.Crowell-Davis S, Murray T, Mattos de Souza Dantas L. Veterinary Psychopharmacology. 2nd Edition. Wiley Blackwell, Hoboken, NJ, 2019.
Dess N.K., Linwick D., Patterson J., Overmier J.B., Levine S. Immediate and proactive effects of controllability and predictability on plasma cortisol responses to shocks in dogs. Behav. Neurosci. 1983;97:1005–1016
Döring D, Roscher A, Scheipl F, Küchenhoff H, Erhard MH. Fear-related behaviour of dogs in veterinary practice. Vet J. 2009 Oct; 182(1):38-43.
Flecknell P, Cruz I, Liles J, Whelan G. Induction of anaesthesia with halothane and isoflurane in the rabbit: a comparison of the use of a face-mask or an anaesthetic chamber. Lab Anim. 1996: 30(1):67-74.
Flecknell P, Roughan J, Hedenqvist P. Induction of anaesthesia with sevoflurane and isoflurane in the rabbit. Lab Anim. 1999 (33):41-46.
Grubb T, Sager J, Gaynor JS, Montgomery E, Parker JA, Shafford H, Tearney C. 2020 AAHA Anesthesia and Monitoring Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2020; In press.
Hekman JP, Karas A, Sharp CR. Psychogenic stress in hospitalized dogs: Cross species comparisons, implications for health care, and the challenges of evaluation. Animals. 2014; 4.2:331-347.
Jeyaretnam J, Jones H, Phillips M. Disease and injury among veterinarians. Aust Vet J. 2000 Sep; 78(9):625-9.
Koolhaus, J.M., Meerlo, P., DeBoer, S.F., Strubbe, J.H., Bohus, B., 1997. The temporal dynamics of the stress response. Neurosci. Biobehav. Rev. 21, 775–782.
Landsberg G. Behavioral Management of Fear and Aggression in Your Patients, 2016, pp 519-521. https://www.fetchdvm360.com/wp-content/uploads/2016/08/CVCKC-2016-505-524-low-stress_pet-friendly_practice.pdf. Accessed 23 Feb 2020.
Landsberg G., Hunthausen W., Ackerman L. Behavior Problems of the Dog and Cat. 3rd ed. Saunders Elsevier; Edinburgh, Scotland: 2013.
Lester P, Moore R, Shuster K, Myers D. Chapter 2- Anesthesia and Analgesia. In “The Laboratory Rabbit, Guinea Pig, Hamster and Other Rodents.” American College of Laboratory Medicine. Academic Press, London, 2012; p 33-56.
Lloyd J. Minimizing stress for patients in the veterinary hospital: Why it is important and what can be done about it. Vet Sci. 2017;4(22):1-19.
Mariti C, Bowen J, Campa S, Grebe G, Sighieri C, Gazzano A. Guardians’ Perceptions of Cats’ Welfare and Behavior Regarding Visiting Veterinary Clinics. J Applied Animal Welfare Science. 2016, 19(4):375-384.
Martin K, Martin D. FAS Scale. Fear Free, 2007.
National Research Council (US) Committee on Recognition and Alleviation of Distress in Laboratory Animals. Recognition and Alleviation of Distress in Laboratory Animals. Washington (DC): National Academies Press (US); 2008.
OSHA: https://www.osha.gov/SLTC/wasteanestheticgases/index.html
OSHA: https://www.osha.gov/SLTC/wasteanestheticgases/solutions/index.html
Quimby J. Maropitant Use in Cats, 2020. Available online: https://todaysveterinarypractice.com/maropitant-use-in-cats/. Accessed 13 June 2020.
Quimby J, Smith M, Lunn K. Evaluation of the effects of hospital visit stress on physiologic parameters in the cat. J. Feline Med. Surg. 2011, 13:733-737.
Rand JS, Kinnaird E, Baglioni A, et al. Acute stress hyperglycemia in cats is associated with struggling and increased concentrations of lactate and norepinephrine. J Vet Intern Med. 2002;16(123-132).
Reiter C, Christy A, Olsen C, Bentzel D. Response to Isoflurane-induced anesthesia in C57BL/6J mice. J Am Assoc Lab Anim Sci. 2017, 56(2):118-121.
Robertson SA, Gogolski SM, Pascoe P, Shafford HL, Sager J, Griffenhagen GM. AAFP Feline Anesthesia Guidelines. J Feline Med Surg. 2018 Jul;20(7):602-634.
Rodan I. Understanding feline behavior and application for appropriate handling and management. Topics in Companion Animal Medicine. 2010;24(4):178-188.
Rodan I, Cannon M. Chapter 9: The Cat in the Veterinary Practice. In “Feline Behavioral Health and Welfare.” Elsevier Health Sciences, 2015, p 102-111.
Rodan I, Sundahl E, Carney H, Gagnon AC, Heath S, Landsberg G, Seksel K, Yin S. AAFP and ISFM feline-friendly handling guidelines. J Feline Med Surg. 2011 May;13(5):364-7.
Scheftel JM, Elchos BL, Rubin CS, Decker JA. Review of hazards to female reproductive health in veterinary practice. J Am Vet Med Assoc. 2017 Apr 15;250(8):862-872.
Shafford H. Serenity Now: Practical Sedation Options for Cats and Dogs, 2016. https://vetanesthesiaspecialists.com/wp-content/uploads/2015/05/SedationOptions_DogsAndCats_Shafford_updated2017.pdf. Accessed 23 Feb 2020.
Shirangi A, Fritschi L, Holman CD. Maternal occupational exposures and risk of spontaneous abortion in veterinary practice. Occup Environ Med. 2008 Nov;65(11):719-25.
Steagall PV, Monteiro-Steagall BP, Taylor PM. A review of the studies using buprenorphine in cats. J Vet Intern Med. 2014 May-Jun;28(3):762-70.
Subramaniam K, Subramaniam B, Steinbrook RA. Ketamine as adjuvant analgesic to opioids: A quantitative and qualitative systematic review. Anesth Anal 2004; 99(2):482-495.
Tynes V.V. The Physiologic Effects of Fear, 2014. Available online: http://veterinarymedicine.dvm360.com/physiologic-effects-fear. Accessed 13 April 2020.
Van Haaften K, Forsythe L, Stelow E, Bain M. Effects of a single reappointment dose of gabapentin on signs of stress in cats during transportation and veterinary examination. J of Am Vet Med Assoc. 2017;15(10):1175-1181.
Volk JO, Felsted KE, Thomas JG, Siren CW. Executive summary of the Bayer veterinary care usage study. J Am Vet Med Assoc. 2011 May 15; 238(10):1275-82.
Westropp JL, Kass PH, Buffington CA. Evaluation of the effects of stress in cats with idiopathic cystitis. Am J Vet Res. 2006;67:731-736.
Yin S. Low stress handling, restraint and behavior modification of dogs and cats. CattleDog Publishing, 2009.
This article was reviewed/edited by board-certified veterinary behaviorist Dr. Kenneth Martin and/or veterinary technician specialist in behavior Debbie Martin, LVT.